誰でも分かる技術
誰でも分かる鋳物基礎講座
銅合金鋳物の材質と基礎知識
3-2「溶解と凝固」
3.2.1 溶湯中ガス、溶湯処理
鋳物の品質に大きく影響する因子として、溶湯中のガス量ならびに凝固過程が挙げられます。それぞれブローホールの生成ならびに引け巣生成に大きく作用いたします。今回は銅合金溶湯のガス吸収に関する基本事項を記述致します。
銅合金鋳物の品質に密接に関係するガスは水素と酸素ですが、これらのガスは水蒸気反応として関与します。アルミニウム合金では水素ガスの単独ガスが問題となりますが、銅合金では二つの単独ガスが反応して水蒸気H2Oとなり大いに異なります。鋳鉄ではガスが問題となることはあまりありません(ただし加炭材からの窒素吸収が問題となることがあります)。鋳鋼では酸素ガスの挙動が最大の問題ですが、酸素は溶鋼中の炭素と反応してCOガスとして関与致します。反応ガスが問題となる点では鋼と銅は類似しております。しかし反応が大きく異なります。銅では水素と酸素の二つの溶解しているガスが反応するのであり、鋼では酸素ガスと最重要溶質元素である炭素と反応致します。
先ず銅中に水素ガスがどれほど溶解されるかを見てみましょう。実際の溶解は大気雰囲気下で通常は行われますが、水素ガス雰囲気1気圧のもとでの水素ガス溶解度を調べてみましょう。現実の溶解では水素ガス1気圧の溶解は非現実的ですが、このデータから、実際の溶解雰囲気である大気圧下でのことを、化学平衡の考え方を使って後で再考致します。
水素ガスH2は溶解雰囲気から溶湯中に吸収されます。溶解中の水素ガスは原子状に存在します。つまり
H2(雰囲気水素) → 2H(溶銅中に溶解している水素) (1)
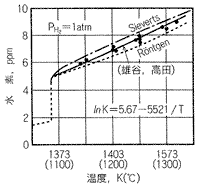
図1 純銅の水素溶解度の温度依存性
(水素ガス雰囲気1気圧 P
H2=760mmHg。素形材センター:銅合金鋳物の生産技術 図2.20)
図1から、水素ガスの溶解度は(質量パーセントで記述すると)、銅の融点1083℃で液体中5.0ppm、固体中1.8ppmであることが判ります(水素の平衡分配係数は0.36。第2回参照)。3.2ppmの水素が液体中に放出され、雰囲気中に逃げていくことが期待されます。固体中に捕捉されれば、ガス欠陥としてブローホール(気泡巣)が生成されます。また別の見方をすれば、固体中の水素溶解度が小さいので、凝固する時ガスは液体中に放出され、ガス圧が雰囲気ガス圧プラスメタルヘッド分より大きくなれば、ブローホールが発生する可能性が大きくなります。ご承知のように1ppm は0.0001%であり、質量基準で表すと、水素ガスはわずかしか溶解(存在)していない,と思われ勝ちです。そこで、ガスの存在量を表す時によく使われる体積基準でしかも100gの銅中に何ccあるかで表してみます。ここでガス量を表示するのは、標準状態と言われる20℃、760mmHg を基準と致します。
水素の密度8.989x10-5 g/ccを用い、水素量5 ppmは5.5 cc/100gとなります。水素量1.8ppmは2.0 cc/100gとなります。(換算には、5.0ppm=5x10-6g/1g。すなわち1gの銅中に水素ガスが5x10-6gあることを示します。5x10-6g/1g=5 x10-6g/(8.989 x10-5g/cc)/1g=5.5cc/100g。つまり銅100gに水素ガスが標準状態で5.5cc存在することになります。 同様に融点での固体銅中の溶解度も体積基準で表すことができます)。凝固に際し、100g の銅で3.5ccの水素ガスが放出されます。 100gの銅は、銅の密度8.92g/ccを用いて、11.2ccの体積を有します。したがって凝固時に放出される水素ガス3.5ccは銅の体積の31.3%にもなり、銅中に容易にブローホールが形成されると理解されます。このようにガス量は質量基準でなく体積基準で表示すると、如何に多くのガスが溶解しているかが判ります。なお、基準状態での水素ガス量ですから、融点では体積は膨張してこの数倍になります(理想気体を仮定して簡単に計算できます)。ところで同様にアルミニウム中の水素溶解度を考えますと、水素ガス雰囲気1気圧PH2=760mmHg下では、融点における液体・固体のそれはそれぞれ0.62ppmと0.03ppm(平衡分配係数0.04)であり、固体の溶解度は非常に小さく、凝固時に液体中の水素ガスはほとんど放出されます。体積で示しますと100gのアルミニウム中に液相側0.7cc/100gと固相側0.03cc/100gの溶解度となります。凝固時に放出される水素ガス量は0.67cc/100gであり、この体積量はアルミニウムの1.8%です。
ところで水素雰囲気の圧力(水素分圧)によって、溶湯中に吸収される水素量はどのように変わるかを考えてみます。水素分圧1気圧は、実際の溶解雰囲気としてはありえませんので、この解答は重要です。この解答はジーベルツ(Sieverts)によって与えられました。ジーベルツの法則とは、金属溶湯に吸収されるガス量は雰囲気ガス分圧の平方根に比例する、と表現され、次式で表されます。
![]() (2)
(2)
ここに、Sは吸収ガス量、Pは分圧、Kは平衡定数です。
(2)式によれば、水素分圧1気圧の時溶解量が5.5cc/100gでしたので、溶解量が2cc/100gとなる水素分圧は0.132気圧(PH2=100mmHg)となります。この数値から、水素分圧が0.132気圧以上であれば、必ず水素ガスは放出される、ことが理解されます。また、分圧を1/100と大きく下げても吸収ガス量は1/10しか下がりません。実際の大気溶解で水素源になるのは、単独の水素でなく、水蒸気の解離による水素ガスです、これについては後述致します。
次に酸素ガスに注目します。水素ガスと同様、酸素も溶解雰囲気から吸収され、
O2 (雰囲気酸素) → 2O (溶銅中に溶解している酸素) (3)
銅と酸素ガスは、銅とCu2Oの共晶を生じます。酸素の固体最大固溶限は0.01%(共晶温度である1065℃において)であり、共晶組成は0.39%です。すなわち、酸素ガスは溶銅中に容易に溶解しますが、凝固に際し酸化銅を形成します。したがって、酸素は水素とは異なり、Sのような酸素と反応して化合物ガス(Sの場合はSO2)が生成されない限り、ガス放出はされず、酸素そのものはブローホールの原因になりえません。
式(1)と(3)で水素と酸素ガスそれぞれ単独で扱いましたが、次式のように水蒸気反応によって両ガスは密接に関係致します。
H2O=H2+1/2O2 (4)
右辺の水素・酸素ガスは式(1)、(3)によって銅中に溶解して参ります。すなわち水蒸気の解離反応によって水素ガスが銅中に吸収されます。単独で大気中にはきわめてわずかな水素ガスしか存在しませんが、水蒸気は大気中にかなり存在します。すなわち湿度から来るものです。各温度における飽和蒸気圧はよく知られております。
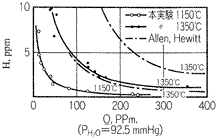
図2 銅-水蒸気間の平衡
(溶解酸素・水素量と温度の関係。
素形材センター:銅合金鋳物の生産技術 図2.19)
図2は水蒸気雰囲気92.5mmHgにおける溶解水素ならびに酸素量の関係を示します。酸素が多ければ平衡溶解水素量はかなり小さいことが了解できます。逆に水素量が多いと酸素量が低くなることが判ります。この図からは酸化溶解することで、平衡溶解水素量を減少させ、その後脱酸処理で溶解酸素を減少させる方法の指導原理を示していることになります。
溶解作業特に溶湯処理についてはまたの機会に引続き述べます。